При какой температуре закипает вода в чайнике
Содержание:
Кипение соленой воды
Связь между водой и ионами соли намного сильнее, чем между молекулами воды. Для закипания соленой воды требуется больше энергии, чтобы можно было разорвать эти связи. Этой энергией является температура.
Также соленая жидкость отличается от пресной низкой концентрацией молекул H2O. В этом случае при нагревании они начинают быстрее двигаться, но не могут образовать достаточно большой пузырь пара, так как реже сталкиваются. Давления маленьких пузырьков недостаточно для их выхода на поверхность.
Для уравнивания водного и атмосферного давления нужно увеличить температуру. Поэтому соленой воде для закипания требуется намного больше времени, чем пресной, а температура кипения будет зависеть от концентрации соли. Известно, что при добавлении 60 г NaCl в 1 л жидкости температура закипания возрастает на 10 °C.
Удельная теплота кипения воды

Удельная теплота кипения воды или парообразования – это физическая величина, отражающая количество теплоты, необходимое для превращения 1 л кипящей воды в пар.
Процесс кипения воды, как и любого другого вещества, происходит с поглощением теплоты. Значительная часть проводимой теплоты необходима для разрыва связей между молекулами воды.
Другая часть теплоты расходуется на процессы, происходящие при расширении пара. В результате поглощения теплоты увеличивается энергия взаимодействия между частицами пара.
Эта энергия становится больше энергии взаимодействия молекул воды. Таким образом, при одинаковой температуре внутренняя энергия пара становится выше внутренней энергии жидкости.
Единица удельной теплоты парообразования в системе СИ: = 1 Дж/кг.
Удельная теплота испарения воды равна 2260 кДж/кг.
Небольшое видео — измерение температуры кипения воды:
При какой температуре вода закипает?
При кипячении воды в кастрюле в первую очередь нагревается е дно и стенки, здесь образуются пузырьки с водяным паром. В них температура заметно выше, нежели в остальной жидкости. Только до некоторого момента давление воды на эти пузырьки не позволяет им вырваться наружу и пар сжимается. Так продолжается пока не сравняется температура пара и основной массы жидкости. Только тогда пузырьки могут всплывать, начинается бурление воды. Это так называемый белый ключ, первая фаза кипения.
Обычно воде достаточно нагреться до 100 градусов Цельсия, чтобы закипеть.
Если подниматься вверх, то на каждые триста метров подъма температура закипания воды уменьшается на 1 градус.
Альпинисты даже жалуются, что высоко в горах у них чай толком не заваривается. На высоте 6 километров вода кипит уже при 80 градусах.
Если атмосфера давления нормальная, то вода закипит при 100 градусов Цельсия. Ну а если атмосферная давления большая то и градус кипения тоже будет большим. Например в Ереване вода кипит около при 96 градусов.
Температура кипения или точка кипения — температура, при которой происходит кипение жидкости,которая находящейся под постоянным давлением. Температура кипения соответствует температуре насыщенного пара над плоской поверхностью кипящей жидкости. Что из себя представляет кипение мы разобрались,а при какой температуре закипает вода? Казалось очевиден -вода кипит при 100С,но это правило работает лишь при нормальном атмосферном давлении то есть 760 мм ртутного столба.А например высоко в горах , где давление не достигает до 760мм ртутного столба вода закипает не достигнув 100 С.И вода может не кипеть достигнув 100 С ,но при условии что эта вода необыкновенно чистая, лишенная каких бы то ни было примесей.
Более или менее чистая вода при нормальном атмосферном давлении закипает при температуре 100 градусов Цельсия (212 градусов по Фаренгейту). Именно эта температура является температурной границей между жидким и газообразным состояниями воды.
Вода закипает при температуре, при которой давление насыщенных паров воды равно внешнему давлению. Поэтому при нормальном атмосферном давлении она закипает при 100 град. Цельсия, и по фигу сколько снаружи градусов
Важно именно давление, а не температура внешней среды. И при нуле градусов вода кипит не в вакууме, а при двлении выше вакуума — несколько мм рт
ст.
Чем выше внешнее давление, тем при большей температуре вода кипит. Но при температуре выше 374 град. уже никакого давления не хватит, чтоб предотвратить е кипение: эта температура называется критической. При такой температуре (и выше) вода уже не может находиться в жидком состоянии.
Вода закипает при нормальных условиях ( температура окружающей среды 20 градусов цельсия, давление около 745-760 миллиметров ртутного столба)при достижении температуры 100 градусов цельсия. Температуры кипения воды зависит от давления, так например высоко в горах температура кипения воды гораздо ниже, а в скороварке составляет 120 градусов цельсия. Это все из за разницы в давлении.
При нормальном атмосферном давлении, которым считается давление, равное 760 мм. ртутного столба (Р = 760 мм. рт. ст.), то в этом случае вода должна закипать и закипает при температуре, равной сто градусов по Цельсию.
Общеизвестно и то, что цифры эти (температура кипения воды) уменьшаются, соотвественно, при снижении атмосферного давления. На вершинах гор (наприер, того же Эвереста) вода закипает уже при температуре 70 градусов. И наоборот — чем выше давление, тем выше/больше температура кипения воды.
Как закипает вода
Как только вода достигнет отметки в 100 градусов, жидкость начнет превращаться в пар. Чтобы легче было представить весь процесс преобразования, наберите в небольшую металлическую кастрюлю воды и поставьте на огонь. Вот что будет происходить:
- вода в кастрюле начнет нагреваться;
- при достижении температуры воды в 100 градусов, на самом дне кастрюли начнут образовываться пузырьки с паром;
- дойдя на поверхности, эти пузырьки лопаются, выпуская пар на свободу;
- количество воды в кастрюле будет постепенно уменьшаться.
Таким образом, через какое-то определенное время, вода в кастрюле полностью исчезнет, превратившись в пар. Кстати, не стоит путать кипение и испарение, эти процессы различаются между собой. Испарение может происходить при любой температуре, в то время как кипение лишь при определенной. Также процесс кипения происходит по всей жидкости, а при испарение вода превращаться в пар, начиная с поверхности воды. При испарении жидкость постепенно будет охлаждаться.
Теплота парообразования.
Теплота парообразования (теплота испарения)
— количество теплоты , которое необходимо сообщить веществу (при постоянном давлении и постоянной температуре) для полного превращения жидкого вещества в пар.
Количество теплоты, необходимое для парообразования (или выделяющееся при конденса-ции). Чтобы вычислить количество теплоты Q
, необходимое для превращения в пар жидкости любой массы, взятой при температуре кипения, нужно удельную теплоту парообразования r
ум-ножить на массу m
:
При конденсации пара происходит выделение такого же количества теплоты.
Температуру кипения необходимо знать, потому что при ее достижении вода превращается в пар, то есть переходит из одного агрегатного состояния в другое.
Мы привыкли к тому, что в кипящей воде можно дезинфицировать посуду, варить продукты, но это не всегда так. В некоторых условиях температура жидкости будет слишком низкой для всего этого.
Физические свойства воды
Температура плавления и кипения водыПлотность воды и льдаТеплоемкость водыСкрытая теплота плавления и испарения водыДиэлектрическая проницаемость водыПоверхностное натяжение воды
Температура плавления и кипения воды
2222222
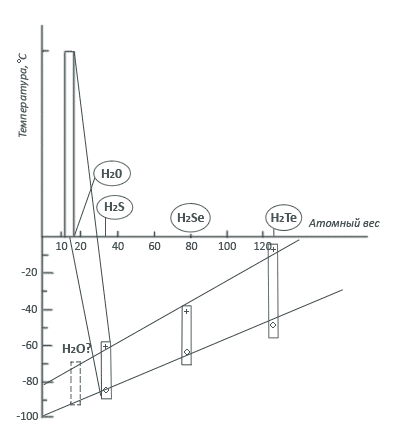
Как видно, при уменьшении атомного веса температуры снижаются совершенно линейно. Область существования жидкой фазы гидридов становится все более «холодной», и если бы гидрид кислорода Н2О был нормальным соединением, похожим на своих соседей по шестой группе, то жидкая вода существовала бы в диапазоне от -80° С до -95° С. При более высоких температурах Н2О всегда была бы газом. К счастью для нас и всего живого на Земле, вода аномальна, она не признает периодической закономерности а следует своим законам.
Объясняется это довольно просто — большая часть молекул воды соединена водородными связями. Именно этими связями отличается вода от жидких гидридов H2S, H2Se и H2Te. Если бы их не было, то вода кипела бы уже при минус 95 °C. Энергия водородных связей достаточно велика, и разорвать их можно лишь при значительно более высокой температуре. Даже в газообразном состоянии большое число молекул H2O сохраняет свои водородные связи, объединяясь в димеры (H2O)2. Полностью водородные связи исчезают только при температуре водяного пара 600 °C.
Напомним, что кипение заключается в том, что пузыри пара образуются внутри кипящей жидкости. При нормальном давлении чистая вода кипит при 100 ‘С. В случае подведения тепла через свободную поверхность будет ускоряться процесс поверхностного испарения, но объёмного парообразования, характерного для кипения, не возникает. Кипение может быть осуществлено и понижением внешнего давления, так как в этом случае давление пара, равное внешнему давлению, достигается при более низкой температуре. На вершине очень высокой горы давление и соответственно точка кипения настолько понижаются, что вода становится непригодной для варки пищи — не достигается требуемая температуры воды. При достаточно высоком давлении воду можно нагреть настолько, что в ней может расплавиться свинец (327 °С), и все же она не будет кипеть.
Помимо сверхбольших температур кипения плавления (причем последний процесс требует слишком большой для такой простой жидкости теплоты плавления), аномален сам диапазон существования воды — сто градусов, на которые разнятся эти температуры, — довольно большой диапазон для такой низкомолекулярной жидкости, как вода. Необычайно велики пределы допустимых значении переохлаждения и перегрева воды — при аккуратном нагревании или охлаждении вода остается жидкой от -40 °C до +200 °C. Тем самым температурный диапазон, в котором вода может оставаться жидкой, расширяется до 240 °C.
При нагревании льда сначала температура его повышается, но с момента образования смеси воды со льдом температура будет оставаться неизменной до того момента, пока не расплавится весь лёд. Это объясняется тем, что тепло, подводимое к тающему льду, прежде всего расходуется только на разрушение кристаллов. Температура тающего льда остаётся неизменной до тех пор, пока не произойдёт разрушение всех кристаллов (см. скрытую теплоту плавления).
Литература














