Гальваническое покрытие металла виды, методы, описание процесса
Содержание:
- Краткая история развития и преимущества гальваники
- История открытия химического электричества
- Элемент — вольт
- 6 Гальванический элемент, как химический источник электрической энергии. Электродвижущая сила гальванического элемента
- Принцип — работа — гальванический элемент
- Гальванический способ — покрытие
- Гальваническая батарея
- Как это происходит
- Применение
Краткая история развития и преимущества гальваники
Датой разработки метода гальванического осаждения (вернее, одной из его разновидностей – гальванопластики) считается 1838-й год, когда его изобрел известный ученый Борис Якоби. После разработки данной технологии ученый начал активно внедрять ее в различные производственные процессы, благодаря чему ее и стали использовать монетные дворы и предприятия, занимающиеся производством типографского оборудования, а также специалисты художественных ремесел.
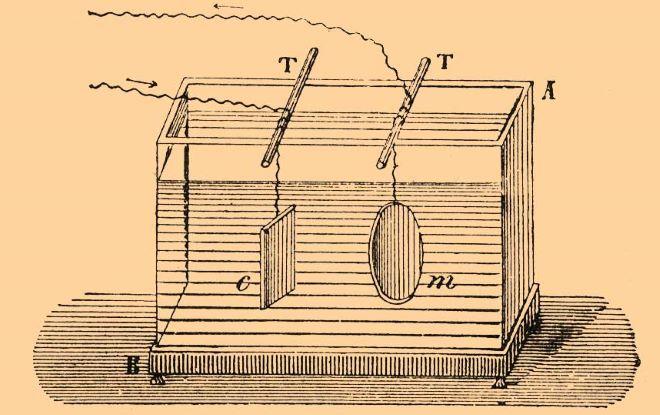
В средние века гальваническая ванна использовалась для съемки копий медалей, которые опускались в раствор в качестве катода (m)
Свое название гальваника получила не в честь изобретателя данной технологии – Бориса Якоби, а в честь итальянского ученого Луиджи Гальвани, который начал применять метод электрохимической обработки изделий практически одновременно с Якоби.
К наиболее значимым преимуществам покрытия изделий слоем металла при помощи гальваники можно отнести следующие.
- Гальванические покрытия могут без проблем наноситься на детали, отличающиеся даже очень сложной конфигурацией.
- Формируемое при помощи данной технологии покрытие отличается высокой плотностью и равномерностью толщины.
- Покрытие, нанесенное методом гальваники, характеризуется отличной адгезией с обработанной поверхностью.
- Защитные и декоративные характеристики выполненных с помощью гальваники покрытий, если они сформированы в строгом соответствии с технологическими требованиями, находятся на самом высоком уровне.
- Толщину наносимого с помощью гальваники слоя металла можно легко регулировать.

Технология гальванопластики настолько доступна, что позволяет самостоятельно создавать установки, вполне конкурирующие с заводскими моделями
С термином «гальваника» можно столкнуться не только в различных отраслях промышленности и ювелирном деле, но и в косметологии. Процесс, который подразумевается под таким названием косметологической процедуры, сложно назвать гальваникой в полном смысле слова, тем не менее термин прижился, и гальваническая чистка кожи лица пользуется большой популярностью в наше время. При выполнении такой чистки на кожу воздействуют токами малой мощности, благодаря чему жиры, скопившиеся в ее глубинных слоях, разжижаются и легко выходят через поры.
История открытия химического электричества
Мало известен факт, что в 1752 году гальваническое электричество упоминалось Иоганном Георгом. Издание Исследование происхождения приятных и неприятных ощущений, выпущенное Берлинской академией наук, даже придавало явлению вполне правильное толкование. Опыт: серебряную и свинцовую пластины соединяли с одного конца, а противоположные с разных сторон прикладывались к языку. На рецепторах наблюдается вкус железного купороса. Читатели уже догадались, описанный способ проверки батареек часто использовали в СССР.

Химическое электричество
Объяснение явления: видимо, имеются некие частицы металла, раздражающие рецепторы языка. Частицы испускаются одной пластиной при соприкосновении. Причём один металл при этом растворяется. Собственно, налицо принцип действия гальванического элемента, где цинковая пластина постепенно исчезает, отдавая энергию химических связей электрическому току. Объяснение сделано за полвека до официального доклада Королевскому обществу Лондона Алессандро Вольта об открытии первого источника питания. Но, как происходит часто с открытиями, к примеру, электромагнитным взаимодействием, опыт остался незамечен широкой научной общественностью и не исследован должным образом.
Добавим, это оказалось связано с недавней отменой преследования за колдовство: немногие решались после печального опыта «ведьм» на изучение непонятных явлений. Иначе обстояло дело с Луиджи Гальвани, с 1775 года работающим на кафедре анатомии в Болонье. Его специализаций считались раздражители нервной системы, но светило оставил значимый след не в области физиологии. Ученик Беккарии активно занимался электричеством. Во второй половине 1780 года, как следует из воспоминаний учёного (1791, De Viribus Electricitatis in Motu Muscylary: Commentarii Bononiensi, том 7, стр. 363), в очередной раз производилось препарирование лягушки (опыты и потом длились долгие годы).
Примечательно, что необычное явление подмечено ассистентом, в точности, как с отклонением стрелки компаса проводом с электрическим током: открытие сделали лишь косвенно связанные с научными исследованиями люди. Наблюдение касалось подергиваний нижних конечностей лягушки. В ходе опыта ассистент задел внутренний бедренный нерв препарируемого животного, ножки дёрнулись. Рядом, на столе стоял электростатический генератор, на приборе проскочила искра. Луиджи Гальвани немедленно загорелся идеей повторить опыт. Что удалось. И опять на машине проскочила искра.
Опыты Луиджи Гальвани
Образовалась параллель связи с электричеством, и Гальвани возжелал узнать, станет ли на лягушку действовать подобным образом гроза. Оказалось, что природные катаклизмы не оказывают заметного воздействия. Лягушки, прикреплённые медными крючками за спинной мозг к железной ограде, дёргались вне зависимости от погодных условий. Опыты не удавалось реализовать со 100-процентной повторяемостью, атмосфера воздействия не оказывала. В итоге Гальвани нашёл сонм пар, составленных из разных металлов, которые при соприкосновении между собой и нервом вызывали подёргивание лапок у лягушки. Сегодня явление объясняют различной степенью электроотрицательности материалов. К примеру, известно, что нельзя алюминиевые пластины клепать медью, металлы составляют гальваническую пару с ярко выраженными свойствами.
Гальвани справедливо заметил, что образуется замкнутая электрическая цепь, предположил, что лягушка содержит животное электричество, разряжаемое подобно лейденской банке. Алессандро Вольта не принял объяснения. Внимательно изучив описание экспериментов, Вольта выдвинул объяснение, что ток возникает при объединении двух металлов, непосредственно или через электролит тела биологического существа. Причина возникновения тока кроется в материалах, а лягушка служит простым индикатором явления. Цитата Вольты из письма, адресованного редактору научного журнала:
Элемент — вольт
В случае элемента Вольта ( § 6) электроды из цинка и меди погружены в раствор серной кислоты, который не содержит ни ионов цинка, ни ионов меди. Однако это имеет место только в первый момент после погружения. В дальнейшем же цинк и медь входят в раствор, так что этот случай принципиально не отличается от рассмотренного выше.
|
Схема гальванического элемента. |
В настоящее время элемент Вольта не применяется, так как созданы более совершенные элементы.
Улучшится ли качество элемента Вольта, et H удалить водород с положительного электрода механически, напри — йер, все Время протирая медную пластину жесткой щеточкой.
Улучшится ли качество элемента Вольта, если удалять водород с положительного электрода механически, например, все время протирая медную пластину жесткой щеточкой.
Работа этого элемента аналогична работе элемента Вольта: ионы Н движутся к берегам щели ( катод), рекомбинируют там в молекулы ( 2Н 2е — Н2), нейтрализуя электроны, и образуют газообразный слой; ионы SOi связывают в растворе ионы Zn, которые переходят в раствор, оставляя свои электроны на цинковом аноде.
В результате этого электродвижущая сила элемента Вольта непрерывно падает. Смещение величины потенциала положительного электрода в сторону более отрицательных значений называется поляризацией и может быть обусловлено наряду с указанными выше и другими причинами. Например, замедленностью реакции разряда ионов на электроде, которая требует дополнительного напряжения. Процесс устранения поляризации называется деполяризацией.
Рассмотрим процессы, протекающие в элементе Вольта при разряде.
|
Гальванический элемент Якоби — Даниэля. Растворы раз. |
Активный электрод ( цинк в элементе Вольта) также подвергается поляризации, но в значительно меньшей степени и в обратном направлении — в том смысле, что по мере работы элемента и увеличения концентрации ионов металла переход в раствор новых ионов замедляется, и потенциал электрода становится более положительным.
Рассмотрим процессы, протекающие в элементе Вольта при разряде. Разрядом называется получение электрической энергии от химического источника тока при подключении к нему нагрузки. Атомы цинка теряют электроны и переходят в виде ионов в раствор через границу цинк — раствор. Таким образом, на цинковой пластине происходит окисление цинка. Электроны переходят через внешнюю цепь к медной пластине и нейтрализуют положительные ионы водорода, подошедшие к этой пластине через границу раствор — медь. Образовавшиеся атомы водорода объединяются в молекулы, на поверхности меди наблюдается выделение пузырьков газообразного водорода.
В процессе генерирования тока цинковая пластинка элемента Вольта растворяется, образуя цинковый купорос. Когда цинк полностью израсходуется, элемент перестает быть источником тока. Таким образом, гальванический элемент работает за счет собственной химической энергии. В нем осуществляется необратимый процесс непосредственного преобразования энергии химических реакций Б электрическую jiicprmo постоянного тока.
Простейшим первичным ( гальваническим) элементом является элемент Вольта ( фиг.
|
К упражнению. |
Если цепь составлена, например, из элементов Вольта, то медный электрод каждого элемента имеет потенциал на 1 1 вольта выше, чем цинковый электрод того же элемента.
6 Гальванический элемент, как химический источник электрической энергии. Электродвижущая сила гальванического элемента
Гальванический
элемент (химический источник тока) –
это устройство, в котором химическая
энергия окислительно-восстановительной
реакции превращается в электрическую.
Гальванический элемент состоит из двух
электродов (полуэлементов). Между
растворами отдельных электродов
устанавливается контакт с помощью
электролитического мостика, заполненного
насыщенным раствором KCl (солевой мостик)
или с помощью мембраны. Они обеспечивают
электрическую проводимость между
растворами, но препятствуют их взаимной
диффузии и являются вместе с электродами
внутренней цепью гальванического
элемента. Внешняя цепь гальванического
элемента – это выводы электродов. По
внешней цепи осуществляется переход
электронов от одного металла к другому.
В гальваническом
элементе между двумя электродами
возникает электродвижущая сила (ЭДС),
равная разности двух электродных
потенциалов. Электродвижущая сила
гальванического элемента – величина
всегда положительная и рассчитывается
по формуле:
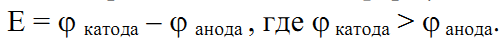
Различают
гальванические элементы химические
(биметаллические), концентрационные,
газовые и топливные.
Химические
гальванические элементы
состоят из двух металлов, опущенных в
растворы своих солей. На поверхности
металлических электродов возникает
двойной электрический слой и устанавливается
равновесие
Me
⇄
Men+
+ nē.
При этом возникает
электродный потенциал. Соединенные
солевым мостиком (мембраной), но
разомкнутые во внешней цепи оба электрода
(гальванический элемент) могут находится
сколько угодно времени не изменяясь.
Но при замыкании внешней цепи начинают
протекать термодинамически необратимые
процессы.
На электрохимически
более активном электроде протекает
процесс окисления, т.е. отдачи электронов.
Процессы окисления в электрохимии
называются анодными процессами, а
электроды, на которых идут процессы
окисления, называются анодами.
На электрохимически
менее активном электроде протекает
процесс восстановления, т.е. принятия
электронов. Процессы восстановления в
электрохимии называются катодными
процессами, а электроды, на которых идут
процессы восстановления, называются
катодами.
При этом электроны,
образующиеся на аноде, по внешней цепи
двигаются к катоду. Движение ионов в
растворе замыкает электрическую цепь
гальванического элемента.
Вследствие этой
химической реакции в гальваническом
элементе возникает движение электронов
во внешней цепи и ионов по внутренней
цепи элемента, т.е. возникает электрический
ток.
Схема химического
гальванического элемента записывается
по правилу «правого плюса». То есть
электрод, являющийся катодом (+), пишется
справа и его роль играет менее активный
металл.
Электролитический
контакт между электродами осуществляется
обычно посредством солевого мостика.
Он препятствует смешиванию электролитов
и обеспечивает протекание электрического
тока по внутренней цепи элемента.
Гальванический
элемент служит источником тока до тех
пор, пока весь анод не растворится или
не израсходуются из раствора катионы,
которые разряжаются на катоде.
Концентрационные
гальванические элементы
состоят из двух одинаковых электродов
(например, серебряных), опущенных в
растворы одного и того же электролита
(например, AgNO3),
но разных концентраций. Источником
электрического тока в таком элементе
служит работа переноса электролита из
более концентрированного раствора в
более разбавленный. Элемент работает
до тех пор, пока сравняются концентрации
катионов у анода и катода.
Газовые
гальванические элементы
состоят из двух газовых электродов,
т.е. электродов, в которых материал
электрода (металл) не участвует в
потенциалопределяющих реакциях.
Примерами газовых электродов могут
служить водородный (рис. 2) и хлорный
электроды.
В топливных
гальванических элементах
(рис. 5) в качестве окисляющихся веществ
обычно используют топлива (уголь, кокс,
горючие газы), а в качестве окислителей
– кислород или воздух.
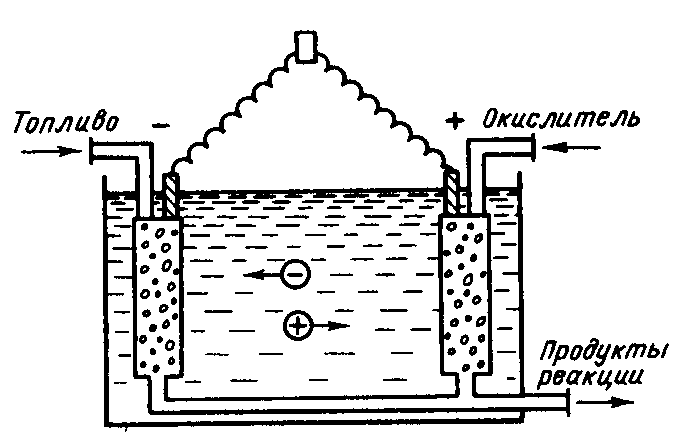
Рисунок 5 – Схема
топливного гальванического элемента
В топливных
гальванических элементах, как и в
обычных, электроды, к которым подаются
окислитель и восстановитель, разделены
ионопроводящим электролитом. Электроды
обычно делают из полых пористых трубок
или пластин. Токообразующий процесс
совершается на границе соприкосновения
электрода с электролитом. Для эффективной
работы топливных элементов часто
применяют катализаторы, которые наносят
на электроды.
Принцип — работа — гальванический элемент
Принцип работы гальванических элементов основан на превращении химической энергии участвующих в нем веществ в электрическую.
Вспомним принцип работы гальванических элементов, уже рассмотренный в курсе неорганической химии. Простейший гальванический элемент получается, если цинковую и медную пластинки погрузить в растворы их солей ( разделенные диафрагмой) и соединить электроды металлическим проводником. Появление в цепи электрического тока обусловливается при этом окислительно-восстановительными процессами, происходящими на электродах. Цинковая пластинка гальванического элемента частично растворяется, и катионы Zn2 переходят в раствор, а оставшиеся на пластинке электроны сообщают ей отрицательный заряд.
Вспомним принцип работы гальванических элементов, уже рассмотренный в курсе неорганической химии.
Вспомним принцип работы гальванических элементов, уже рассмотренный в курсе неорганической химии. Простейший гальванический элемент получается, если цинковую и медную пластинки погрузить в растворы их солей ( разделенные диафрагмой) и соединить электроды металлическим проводником. Появление в цепи электрического тока обусловливается при этом окислительно-восстановительными процессами, происходящими на электродах. Цинковая пластинка гальванического элемента частично растворяется, и катионы Zn 2 переходят в раствор, а оставшиеся на пластинке электроны сообщают ей отрицательный заряд.
Вспомним принцип работы гальванических элементов, уже рассмотренный в курсе неорганической химии. Простейший гальванический элемент получается, если цинковую и медную пластинки погрузить в растворы их солей ( разделенные диафрагмой) и соединить электроды металлическим проводником. Появление в цепи электрического тока обусловливается при этом окислительно-восстановительными процессами, происходящими на электродах. Цинковая пластинка гальванического элемента частично растворяется, и катионы Zn2 переходят в раствор, а оставшиеся на пластинке электроны сообщают ей отрицательный заряд.
Охарактеризуйте схему устройства и принцип работы гальванических элементов Якоби — Даниэля и Вестона.
В основу протекторной защиты положен принцип работы гальванического элемента. Создавая условия, при которых трубопровод является катодом, а другой электрод анодом, можно добиться прекращения коррозионного разрушения трубопровода при интенсивном разрушении анода-протектора. Анод протектор изготовляется из материала, обладающего большим отрицательным потенциалом по сравнению с потенциалом защищаемого металла трубопровода. Такой потенциал имеют магний, цинк, алюминий. Срок службы протектора зависит от его массы и вида материала, из которого он изготовлен.
В основу протекторной защиты положен принцип работы гальванического элемента. Анодный процесс сопровождается переходом ионов металла в электролит-грунт ( разрушение протектора), в то время как на катоде происходит разряд этих ионов, и коррозионного разрушения трубопровода в грунте не происходит.
|
Схема установки для определения удельного электрического сопротивления грунта в лабораторных условиях. |
В основу протекторной защиты ( рис. 20) положен принцип работы гальванического элемента. Создавая условия, при которых трубопровод является катодом, а другой электрод анодом, можно добиться прекращения коррозионного разрушения трубопровода при интенсивном разрушении анода-протектора.
|
Нормальные потенциалы некоторых металлов. |
Защита металлических конструкций от электрохимической коррозии протекторами осуществляется по принципу работы гальванического элемента.
|
Принципиальная схема протекторной защиты. / — трубопровод. 2 — дренажный провод. 3 — г колонка. 4 — активатор. 5 — протектор. |
Протекторная защита относится к электрохимическому виду защиты трубопровода от коррозии и основана на принципе работы гальванического элемента. Она автономна, благодаря чему может использоваться в районах, где отсутствуют источники электроэнергии.
Протекторная защита относится к электрохимическому виду защиты трубопровода от коррозии и основана на принципе работы гальванического элемента. Она автономна, благодаря чему, может использоваться в районах, где отсутствуют источники электроэнергии.
Гальванический способ — покрытие
|
Структура поверхности. |
Гальванический способ покрытия заключается в том, что на поверхность защищаемого металла наносится тонкий слой защищающего металла при помощи электролиза. При этом защищаемое изделие служит катодом, а покрывающий металл-анодом. Гальванический способ позволяет наносить слои равномерной толщины и высокой химической чистоты.
Гальванический способ покрытия, заключающийся в нанесении на поверхность металлических изделий или полуфабрикатов слоев другого металла при помощи электрического тока или без него.
Гальванический способ покрытия заключается в осаждении на изделии защитного металла при помощи электротока. Он имеет большое распространение, так как дает защитные покрытия хорошего качества, позволяет легко регулировать толщину защитного слоя, экономно расходовать дефицитные цветные металлы.
Гальванический способ покрытия поверхностей не является наилучшим путем увеличения сопротивляемости трущихся поверхностей схватыванию. Однако этот способ наиболее приемлем, так как он прост, технологичен, позволяет вести работы с большой точностью, покрывать поверхность деталей тонким слоем электролитического металла ( а это сохраняет прочностные свойства основного металла), не связан с нагревом, что гарантирует от структурных изменений в металле, не деформирует детали, не требует изменения их конструкции и вместе с тем резко меняет физико-химическую картину поверхностных явлений, происходящих в процессе трения.
При гальваническом способе покрытия изделие из основного металла опускают в электролизеры ( ванны), где под действием постоянного электрического тока на поверхности защищаемого металла осаждается никель, хром, цинк или другой металл.
При гальваническом способе покрытия изделия опускают в гальванические ванны, где под действием электрического тока происходит осаждение металла на поверхности защищаемого изделия. Широко применяют гальваническое покрытие никелем, хромом, цинком и другими металлами.
По технико-экономическим соображениям гальванический способ покрытия более выгоден, чем все другие способы ( осаждение в расплавленном металле, диффузионный, металлизация распылением), Электроосажденное покрытие отличается высокой чистотой, большей химической стойкостью и потому большим сроком защиты металла от коррозии. Такие покрытия имеют прочное сцепление с основным металлом. Расход цинка на единицу поверхности изделия значительно меньший, чем при других способах покрытия.
|
Уплотняющие устрой. |
Пленки металлов наносятся на сепараторы, а иногда и на беговые дорожки; для этого применяют гальванический способ покрытия и распыление.
Гальваническое покрытие сплавом Pb-In, в силу своей однородности по всей толщине слоя, исключает возможность избирательного коррозионного разрушения. Поэтому гальваническому способу покрытия вкладышей сплавом Pb-In следует отдать предпочтение.
Выше отмечалось, что существует несколько методов цинкования, из которых горячий метод имеет наибольшее распространение. Покрытие, полученное гальваническим способом, отличается высокой чистотой, большей химической стойкостью и более длительным сроком защиты основного металла от коррозии. Наибольшая прочность сцепления цинкового покрытия с основным металлом достигается при гальваническом способе покрытия. Расход цинка на единицу покрываемой поверхности при одинаковых защитных качествах покрытия значительно меньше при гальваническом способе покрытия по сравнению, например, с горячим.
Выше отмечалось, что существует несколько методов цинкования, из которых горячий метод имеет наибольшее распространение. Покрытие, полученное гальваническим способом, отличается высокой чистотой, большей химической стойкостью и более длительным сроком защиты основного металла от коррозии. Наибольшая прочность сцепления цинкового покрытия с основным металлом достигается при гальваническом способе покрытия. Расход цинка на единицу покрываемой поверхности при одинаковых защитных качествах покрытия значительно меньше при гальваническом способе покрытия по сравнению, например, с горячим.
Гальваническая батарея
Если применять большую силу тока, то гальваническую батарею заменяют стабилизатором тока от сети, который дает колебания силы тока в пределах 0 1 %, или же амперостатом.
При испытании керамических сосудов, применявшихся в гальванических батареях, Якоби графитовым карандашом делал на них пометки и обратил внимание на то, что буквы, напи-санные графитом, покрылись медью.
Вращение якоря динамомашины Грамма при подключении к ней гальванической батареи — демонстрация перехода химического движения в механическое.
Например, для того чтобы измерить электродвижущую силу гальванической батареи, используются два электрометра.
Москве перед Лефортовским дворцом, применив в качестве источника тока гальваническую батарею, состоявшую из 600 элементов Бунзена.
Батарея дисковых аккумуляторов типа 7Д — ОД по габаритам соответствует гальванической батарее Крона, но в отличие от нее допускает многократное использование. Сухая батарея выходит из строя после 40 ч работы в транзисторном приемнике, батарея 7Д — 0 1 в течение 13 мес.
В рассмотренных схемах питания электронных фотовспышек в качестве первичных источников использованы гальванические батареи. Однако иногда возможность регулярной замены батарей бывает затруднена или исключена совсем. В подобных случаях для питания фотовспышек могут быть использованы ручные генераторы напряжения — индукторы. Естественно, необходимость вращения перед каждой вспышкой рукоятки индуктора создает определенные неудобства, ввиду которых этот способ питания и не получил широкого распространения. В то же время существенным достоинством индукторов является постоянная готовность к действию и при достаточно малых габаритах и массе почти неограниченный срок службы.
На начальном этапе развития радиоэлектроники в качестве источников питания преимущественно использовались гальванические батареи, основными недостатками которых ( особенно при постоянных напряжениях в сотни вольт), являются громоздкость и малый срок службы. Поэтому вскоре были разработаны более совершенные устройства, в которых осуществляется преобразование переменного напряжения в постоянное. Удобство таких источников питания связано с тем, что в них применяют низкочастотное переменное напряжение так называемой промышленной частоты. Однако развитие транзисторной электроники, особенно маломощных переносных устройств, для питания которых нужны низковольтные маломощные источники, снова вызвало интерес к гальваническим батареям.
Электрическое сопротивление когерера, последовательно включенного в цепь чувствительного электромагнитного реле и гальванической батареи, резко изменялось в поле электромагнитной волны, что вызывало срабатывание реле.
Труве был оборудован электрический управляемый аэростат; установленные на аэростате электродвигатели получали ток от гальванической батареи, находившейся в кабине аэростата.
|
Определение группы соединений обмоток трансформатора методом постоянного тока. |
Источником тока может быть генератор постоянного тока, аккумуляторная батарея, выпрямительная установка или даже гальваническая батарея.
Итак, мы видим, что кольцевой якорь работающей динамомашины ямеет большое сходство с двумя параллельно соединенными гальваническими батареями ( черт.
В начальном этапе развития радиоэлектроники в качестве источников электропитания преимущественно использовались химические источники постоянного тока — гальванические батареи и аккумуляторы, являющиеся представителями первичных источников электропитания.
Как это происходит
Участники волшебного действия гальванического покрытия: основа-металл, постоянный ток и металлический электролит. Каков металл – таково и покрытие. Если пропускать ток (напряжение) через свинец, то и покрытие будет свинцовое, если нужна гальванопластика серебра, то и пластина, опущенная в электролит, должна быть серебряная.
Толщина гальванического покрытия драгоценными и полудрагоценными металлами составляет всего 2 микрона (1 мкм равен 0,001 мм), но делает изделие необычайно износостойким, к тому же улучшает его внешний вид. Электролитическая плёнка получается плотной, ровной, без наплывов, пузырьков и пустот, лишая ювелирное изделие хрупкости и придавая ему яркий, отражающий солнце свет, которым не прошедшие гальванизацию украшения не обладают. В частности, коэффициент отражения гальванопластического серебра равен 98%!

Электролит – водный раствор кислот или солей, в котором (под действием тока) молекулы солей и кислот распадаются на ионы. Положительные ионы водорода и металлов стремятся к катоду – электрод со знаком «минус», а отрицательные ионы кислотных остатков – к аноду со знаком «плюс».
Покрываемое изделие выступает в роли катода – принимающая сторона, основа, которой требуется покрытие, а в качестве анода-отдающего используют пластину того металла, чьё гальваническое покрытие хотят получить. Железом? – Пластина железа. Мерцающее холодным инеем родирование? – Пластина благородного родия. И для каждого случая обработка металла будет требовать индивидуального режима электролиза и своей толщины покрытия.
Общими для всех вариантов является так называемая ванна Якоби или гальваническая ванна – сосуд или ёмкость из кислотоустойчивого и не электропроводного материала (стекло, пластик) и источника постоянного тока (батарейка, аккумулятор, выпрямитель). К слову сказать, первую в мире батарейку изобрёл всё тот же «Яко бы Борис».
Но, обработка металла другим металлом – это не только увлекательное развлечение и не просто поверхностное блестящее покрытие. Дешевизна и простота выполнения метода, прочность покрытия нашли широкое распространение в машиностроении, авиастроении, радиотехнической, электронной и строительной промышленностях. Это всегда конечная, чистовая обработка.
Что значит чистовая обработка в промышленности? Это значит, что после гальваники изделия для этих сфер промышленности приобретают такие качества, как повышенная твёрдость, увеличение сопротивляемости к износу, стойкость к коррозии, механическая и электрохимическая защита при различных условиях эксплуатации + равномерный по толщине блестящий слой на любой конфигурации деталей, не требующий никаких дополнительных действий. Вот что такое чистовая гальваническая обработка.
Применение
В большинстве случаев возможность систематического использования аккумуляторов есть только в портативных устройствах радиосвязи и иной цифровой технике, где используются литий-ионные аккумуляторы и система контроля заряда-разряда встроена в устройство.
В бюджетном сегменте «простые» никель-металл-гидридные и никель-кадмиевые аккумуляторы используются в качестве бюджетной замены щелочных элементов питания (батареек).
В качестве источника тока для бюджетного аккумуляторного электроинструмента используются никель-кадмиевые аккумуляторы.
Если в первом случае обычно есть возможность выбирать между бюджетным устройством «стандартного» заряда и зарядным устройством с контролем заряда (капельный заряд, импульсный заряд, ускоренный заряд с контролем напряжения и т. д.), то во втором случае изделие комплектуется, как правило, с трансформаторным источником питания для зарядки постоянным током, что при несоблюдении технических условий эксплуатации аккумулятора снижает срок его службы.